生命科学の革新;タンパク質の構造をより良く知り、人工的に変える技術
タンパク質はわれわれ人間が生きて行く上で必須なものである。例えば目が見えるのは、光を受け止めて神経にその情報を伝えるタンパク質があるからである。考えを巡らす事ができるのは脳内外の神経細胞の働きであり、神経細胞には情報を伝えるためのタンパク質がある。薬は、血液を巡り作用する細胞の表面にたどり着くと細胞の膜に結合するタンパク質があってそれに結合し初めて細胞内に入ることができる。このように薬は人工的なものだが、どの薬もわれわれの体の中で特定のタンパク質に結合して初めて作用する。
今やヒトの三人に一人は癌で亡くなる。この原因としては、細胞を癌化するタンパク質が関わる。環境にある物質によりこのタンパク質の遺伝子(がん遺伝子という)が突然変異を起こし、本来の働きをしなくなることによる。これは、がん遺伝子に書き込まれたタンパク質のアミノ酸配列の指令書が変化し、変化した遺伝子からできるタンパク質が機能を変えるからである。こうした医学や分子生物学の知識をもとに、遺伝子に突然変異が起きないようにタバコを吸う事が禁止された。また変異したがん遺伝子を元に戻すことや、正常な遺伝子を体に送り込んで癌を治すこと(遺伝子治療)がすでに進められている。
癌を引き起こす元となるタンパク質や薬が作用するタンパク質の働きを理解することは、生命科学や医学のもっとも重要な課題の一つである。
タンパク質が特定の働きをするのは、構成しているアミノ酸がどのように並んでいるかによっている。このアミノ酸の並び方は遺伝子DNAを構成するヌクレオチドという物質の並び方で決まってくる(図)。兄弟でも顔の形が違い性格も違うのは、ヌクレオチドの並び方が兄弟でも違うからであり、それは体を構成するたんぱく質のアミノ酸の配列に違いがあることによる。
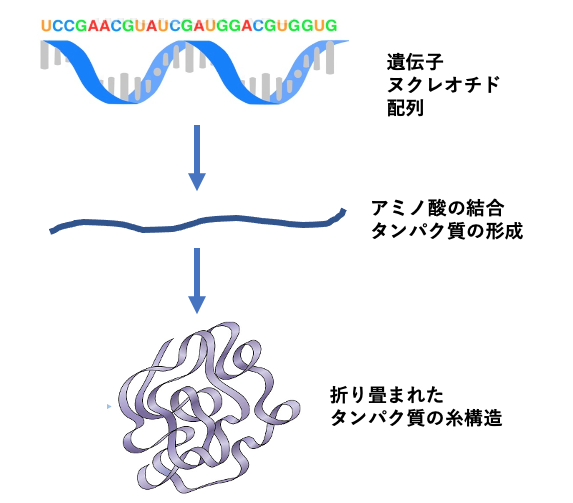
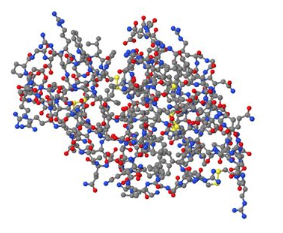
タンパク質はアミノ酸が複数並んで繋がった糸状を合成の当初はしている。しかし、アミノ酸が繋がり始めると糸状構造は折り畳まれて複雑な立体的な構造をとるようになる(図参照)。完成すると、タンパク質分子全体としては凹凸がある構造(図)になる。多くの場合窪みのような構造の部分がその働きにとって重要となる。この凹んだ部分に酵素の化学反応の材料(基質という)や薬が結合する。この凹の形状は、酵素ごとに異なっている。薬となる物質はこの凹に基質の代わりに結合し、その酵素の働きを止めるたり、場合によっては機能を高めたりする。このようなことから、あるタンパク質の分子としての立体構造を知る事ができれば、その形にあった物質を薬物として合成し使う事ができるようになる。また、細胞の中で、タンパク質の多くは単独ではなく、他のタンパク質と結合して機能している。このタンパク質同士の相互作用やタンパク質とDNAなど核酸との相互作用にもタンパク質の立体構造あるいは表面構造が関わっている。この表面構造に似た物質や短いアミノ酸がつながったもの(ペプチド)を人工的に作って体に与えるとタンパク質同士の相互作用を変えて細胞の機能を変える事ができる。
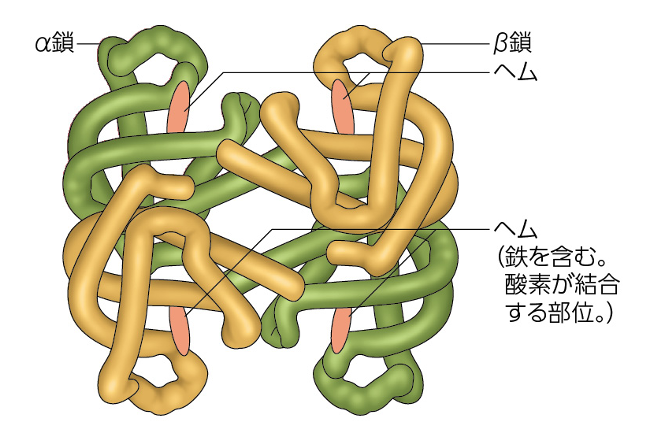
図 タンパク質の立体構造の例(ヘモグロビン、Essential 細胞生物学より引用)
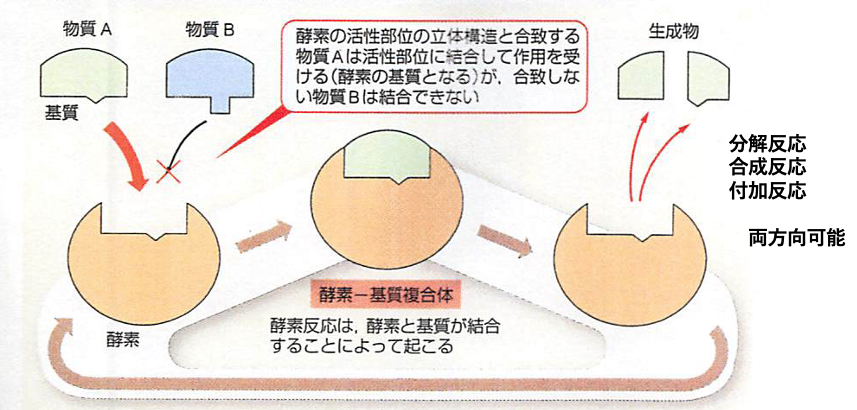
図。 酵素の働きには反応するものが結合するタンパク質立体構造上の窪みが関わる。
タンパク質の立体構造はこのように生物学上の重要な問題に手がかりを与えてくれるが、立体構造を明らかにするには、これまで一つのタンパク質について十年ぐらいかかった。注目するタンパク質を純粋に細胞からとりだし、その結晶を作り、これにX線を当てて原子の分子内での配置を知るという方法が取られてきた。これには時間がかかった。
ヒトのDNAのヌクレオチド配列がすべて解明されてからすでに20年以上たつ。時間のかかるアミノ酸配列のこれまでの決定の仕方によるのではなく、ヌクレオチドの並び方からタンパク質のアミノ酸の並び方を推定し、これに基づいてすぐにタンパク質の中の原子の立体配置を予測することは、この50年近く生命科学者の夢だった。
Google社のディープラーニングを研究するディープマインドと呼ばれるAI(人工知能)研究グループのベーカー博士とジャンパー博士らは、この予測方法を2018年にとうとう見つけ出し、2024年度のノーベル化学賞に輝いた。タンパク質の中でアミノ酸は隣同士で相互作用するとともに離れて位置するアミノ酸同士も相互作用する。例えば正と負の電荷をもつアミノ酸はお互いに引き合う。またシステインというアミノ酸が二つあれば、離れていてもお互いに水素を乖離して結合する。さらにアミノ酸同士を結合する化学結合(ペプチド結合という)は弱い負の電荷を持っており離れたアミノ酸の正の電荷と引き合う。こうした複雑な相互作用をcomputer を使って二人の博士らは既存のデータからAIを使い予測する基盤となるプログラムを2018年に作った。これをアルファフォールド2と名付けた。X線結晶解析の方法でこれまで7万ほどの個別のタンパク質の分子内の立体構造が明らかになっており、プロテインデータバンクとして誰でもアクセスできる。この膨大なデータをもとにアルファフォールド2はできた。
1993年にアミノ酸配列は知られているが立体構造が公表されていないタンパク質を材料に立体構造予測をするコンテスト(CASP)が始まった。このコンテストでアルファーフォールド2は与えられた課題の90パーセントを正確に予測し、断然トップの成績を示した。また以降このプログラムがネット上で誰でも使えるようになっている(https://alphafold.ebi.ac.uk)。こうした功績から2024年度のノーベル化学賞が授与されている。アルファフォールド2を使い病気に関わるタンパク質の立体構造が明らかになり、それに基づいて新薬ができる日も近い。人類にとってこの上もない貢献をするであろう。 参考文献;佐藤祐介 鳥取大学工学部、 Alpha Foldの使い方
